最近,大家都知道生科股見底回升,在眾多生科股中選擇很困難的一件事。康諾亞-B(2162)CM310III期臨床順利針對成人中重度特應性皮炎(AD)療效顯著,也即我們稱的濕疹藥。公司在單抗及雙抗創新研發有很強能力,具有清晰商業化策略,已與多家公司深度合作。
研發實力強勁 加快臨床及商業化
康諾亞集中在過敏和自免疾病領域,還將優秀的產品授權,得到付款資金充實公司的現金流。截至2021年底,公司資金有35億人民幣,去年投入研發總計3.6億人民幣。現時在手的資金足夠維持公司未來3年的研發投入。
公司在2021年與石藥集團先後就CM310及CM326在中重度哮喘和COPD等呼吸系統疾病適應症的中國(不包括香港、澳門和臺灣地區)權益達成合作,並在2021年9月與石藥集團達成戰略聯盟。另外,公司在2021年與諾誠健華(9969)簽署戰略合作協議,進一步深化雙方研發合作,致力於開發First-in-Class大分子創新藥造福患者。
康諾亞現時已經與石藥集團、樂普生物、天廣實及INNOCARE達成商業合作。公司多款產品將因為合作項目加速產品的臨床及推進商業化。
核心產品CM310空間廣闊
康諾亞自研1類新藥CM310獲CDE突破性治療藥物認定,用於治療中重度特應性皮炎(AD)(濕疹)。
濕疹是一種慢性、復發性、炎症性皮膚病,大部分在嬰兒和兒童發生,也可發生於成人。AD最基本的特徵是皮膚乾燥、慢性濕疹樣皮損和劇烈瘙癢,嚴重者影響生活質量。
根據弗若斯特沙利文數據統計,2019年全球特應性皮炎患者的總數已達到6.49億例,同時預計2030年增加至7.55億例,當中以兒童及青少年患者為主,中重度比例高達25-30%。據統計,2019年中國的特應性皮炎患者也高達約6500萬例,預計2024年將增長至7300萬例左右。
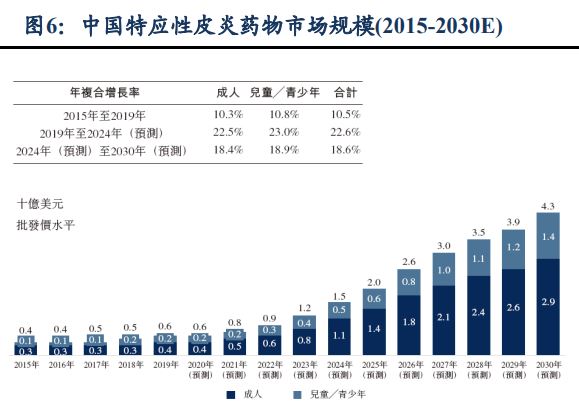
康諾亞的CM310目前針對該適應症正在中國開展III期臨床試驗。有大行預計,公司將在2023年實現首款產品CM310報產,在國內藥企中處於領先地位,有望成為下一個重磅產品,未來市場空間廣闊。
商業化價值高 授權不斷
康諾亞的CM310已領先於其他IL-4Rα產品,除了治療中重度特應性皮炎(AD),在慢性鼻竇炎伴鼻息肉(CRSwNP)達到II期臨床試驗的主要終點,近期即將開展III期臨床。

另外,哮喘適應症也已進入II期臨床。在去年3月,康諾亞已經與石藥集團訂立協議,授權石藥進行CM310在中重度哮喘和慢性阻塞性肺病(COPD)等呼吸系統疾病的獨家開發及商業化許可。 已經獲得7000萬首付款及根據開發進度支付的1億元開發里程碑付款。
未來,產品上市於該地區達成的銷售額獲得銷售里程碑付款和銷售提成。
其他研發管線進展順利
康諾亞在技術領域佈局全面,單抗雙抗ADC,研發能力極高。其中,CMG901是全球首個獲批進入臨床的靶向Claudin18.2的ADC產品。

在4月,CMG901用於治療復發╱難治性胃癌及胃食管結合部腺癌已於近日獲美國食品藥品監督管理局(「FDA」)授予快速通道資格(Fast Track Designation,「FTD」)。
CM313在2021年啟動了I期臨床試驗,並在 2022.1 遞交了治療系統性紅斑狼瘡(SLE)的適應症臨床申請。
CM326是中國首個獲得NMPA臨床試驗申請批准的靶向胸腺基質淋巴細胞生成素(TSLP)的人源化抗體。
同時,康諾亞擁有國內領先CD3雙抗藥物研發平臺,基於自身新型T細胞重定向(nTCE)平臺,已研發出3款CD3雙抗藥物(CM355、CM336、CM350),均獲批進入I期臨床,臨床前3款產品細胞因數釋放量遠小於競品類似物,在保持高抗瘤活性同時擁有極高安全性與耐受性。
結語
康諾亞在過敏自身免疫疾病及腫瘤治療領域研發能力極高,其中CM310商業潛力極大,在治療中重度濕疹療效顯著,安全性良好,造福數億病者。CM310針對成人中重度AD適應症已進入III期臨床,預計2023年申報生產。公司在單抗雙抗ADC能力全面,又與石藥及諾誠健華等企業合作,加速研發及商業化的時間。
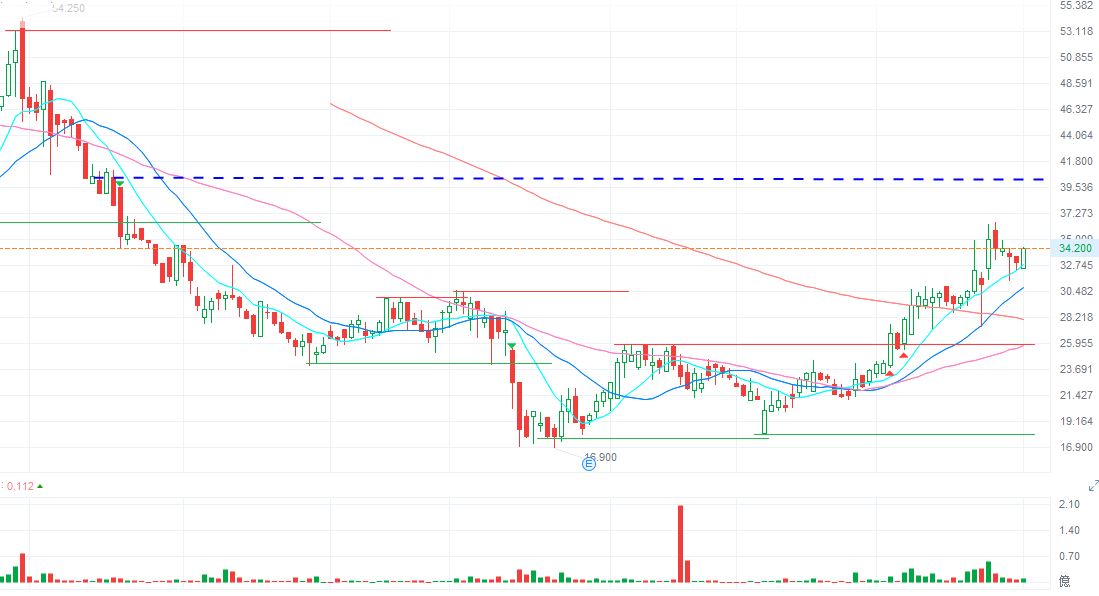
康諾亞股價升至36.4左右出現回調至31元左右,生科股升勢再起,如能突破前高36.45,有力再挑戰40元。